本文以 NirVivo-Pro NIR-II小动物活体荧光成像系统作为用于原位肿瘤血管监测和联合抗血管光热治疗的设备。抗血管治疗对肿瘤治疗有效,但面临血管破坏剂疏水性和非靶向性等挑战,构建肿瘤微环境响应的多模态联合治疗纳米平台意义重大。NIR-II 荧光成像在实时监测肿瘤血管破坏方面有潜力,但现有 NIR-II 光诊疗剂存在多种问题,开发兼具血管破坏过程实时监测和联合治疗功能的新试剂对疗效评估和癌症治疗至关重要。文章报道了开发了一种 pH 响应性的近红外 II 区(NIR-II)光热诊疗剂,用于原位肿瘤血管监测和联合抗血管 / 光热治疗。
实验设计
·合成系列分子并制备纳米颗粒
以吡咯并吡咯氮杂 - BODIPY(PPAB)为电子受体合成具有 D - A - D 结构的 PT - Xs 系列分子,筛选出 PT - 3,将其修饰为两亲性分子 PTG,再与血管破坏剂 DMXAA 共组装成 PTDG 纳米颗粒,并制备不含 DMXAA 的 PTG 纳米颗粒。
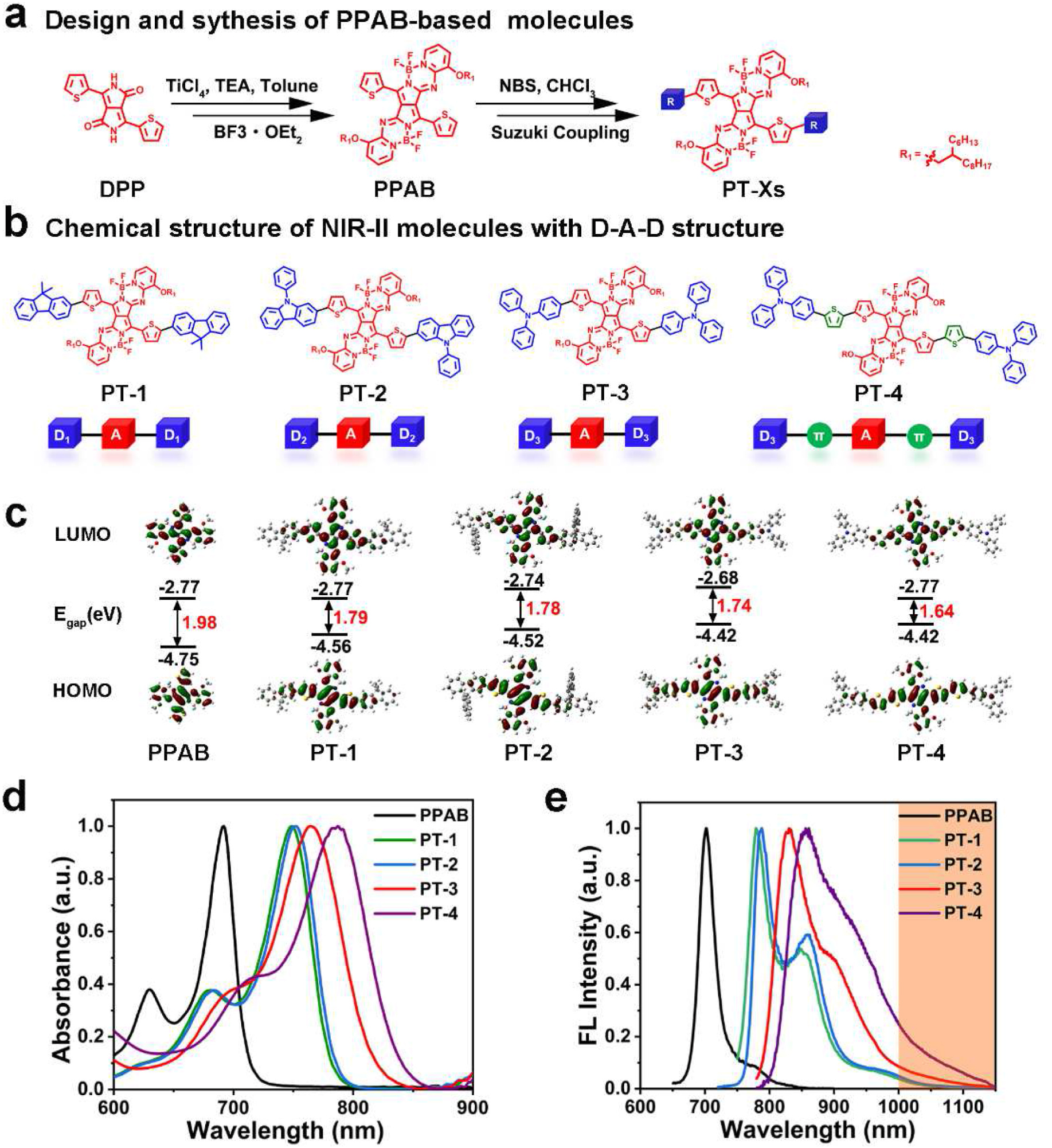
图 1(a):基于 PPAB 的分子(PT - Xs)的设计与合成。(b):具有 D - A - D 结构的 NIR - II 分子(PT - 1 至 PT - 4)的化学结构。(c):通过密度泛函理论(DFT)计算得到的 PT - Xs 的蕞高占据分子轨道(HOMO)、蕞低未占据分子轨道(LUMO)和能隙。(d):PPAB 和 PT - Xs 在二氯甲烷中的归一化吸收光谱和 (e) 荧光光谱。
·表征和测试
对合成的分子和纳米颗粒进行核磁共振(NMR)、质谱(MS)、紫外 - 可见 - 近红外光谱、荧光光谱、透射电子显微镜(TEM)、动态光散射(DLS)、密度泛函理论(DFT)计算等表征;测试 PTDG 纳米颗粒的体外 DMXAA 释放、光物理性质、光热转换效率;通过细胞实验评估其体外抗血管治疗和光热治疗效果;利用 NIR-II 荧光成像技术进行体内全身血管成像、肿瘤血管破坏动态监测、长期肿瘤进展跟踪和体内联合治疗实验,并评估 PTG 纳米颗粒的长期生物safety。
实验结果
·PT - Xs 分子的合成与表征
成功合成 PT - 1 至 PT - 4 分子,其吸收和发射波长随给电子能力增强而红移,PT - 3 在 NIR-II 区域具有蕞高荧光量子产率(1.37%)和亮度(624.86 M⁻¹cm⁻¹),被选作进一步研究对象。
·PTDG 纳米颗粒的制备与表征
PT - 3 修饰后与 PEG 链反应得到 PTG,PTG 与 DMXAA 共组装成 PTDG 纳米颗粒,粒径约 96.0nm,在不同 pH 值下有形态和尺寸变化,酸性条件下可释放 DMXAA,在正常生理环境中稳定性良好。PTDG 纳米颗粒在水中的荧光量子产率为 0.54%(相对量子产率 0.27%),亮度为 119.61 M⁻¹cm⁻¹,NIR-II 成像能力优于吲哚菁绿(ICG),光热转换效率为 40.5%,且光热稳定性良好
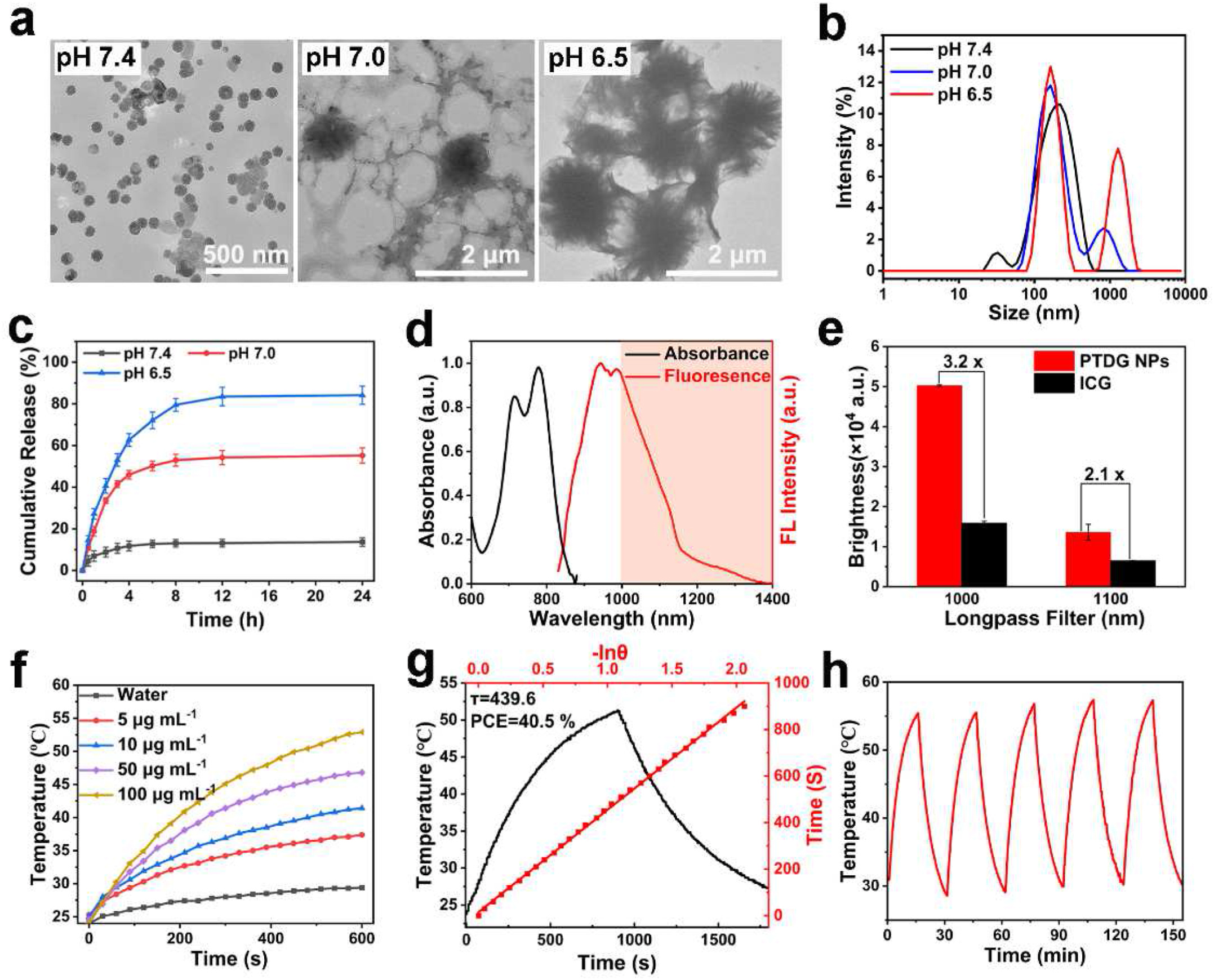
图 2(a):PTDG 纳米颗粒在不同 pH 值(7.4、7.0 和 6.5)的 PBS 中的透射电子显微镜(TEM)图像。(b):动态光散射(DLS)分析。(c):PTDG 纳米颗粒在不同 pH 值的 PBS 中 24 小时内 DMXAA 的释放曲线。(d):PTDG 纳米颗粒的归一化吸收(空白线)和发射(红线)光谱。(e):PTDG 纳米颗粒与 ICG 在水中使用 1000nm 和 1100nm 长通滤光片时的亮度比较。(f):在 750nm 激光照射(0.7W/cm²)下,纯水和不同浓度 PTDG 纳米颗粒的温度变化。(g):PTDG 纳米颗粒(100μg/mL)在 750nm 激光照射 15 分钟后的光热效应以及冷却时间与 - ln 的关系图和冷却期的线性拟合曲线。(h):PTDG 纳米颗粒在 750nm 激光照射(0.7W/cm²)下五个加热 - 冷却循环的温度变化。
· 体外抗血管治疗和光热治疗效果
MTT 和染色实验表明 PTG 纳米颗粒生物相容性好,PTDG 纳米颗粒在黑暗中可有效杀伤血管内皮细胞,且在肿瘤酸性微环境下对血管的破坏作用更强,对 4T1 细胞也有显著的抗血管和光热联合治疗效果。
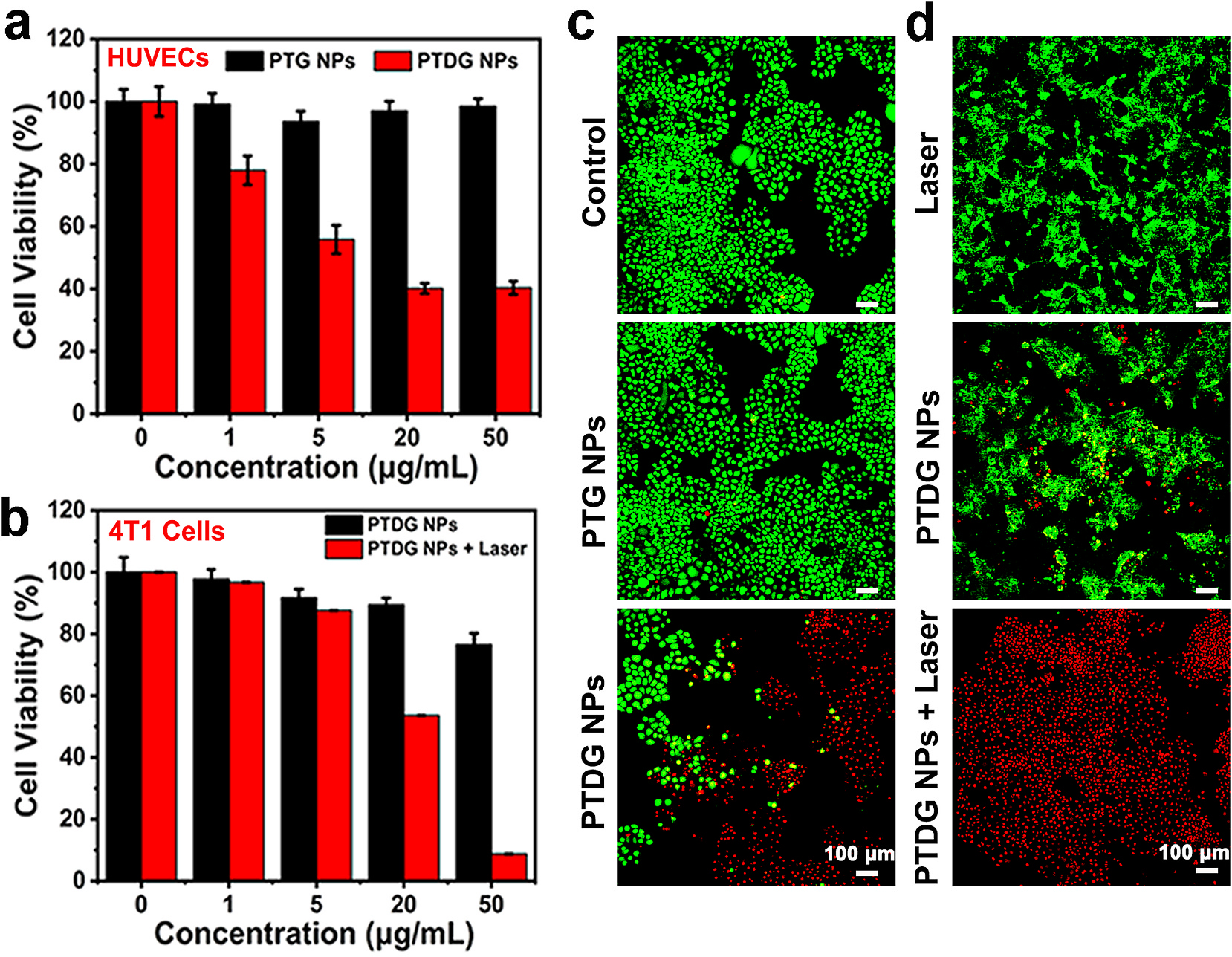
图 3(a):通过 MTT 法测定不同浓度的 PTG 纳米颗粒和 PTDG 纳米颗粒在黑暗中孵育 24 小时后人脐静脉内皮细胞(HUVECs)的相对存活率。(b):通过 MTT 法测定 4T1 细胞在黑暗中或 750nm 激光照射(0.7W/cm²,10 分钟)下与 PTDG 纳米颗粒孵育后的相对存活率。(c):用 50μg/mL 的 PTG 纳米颗粒和 PTDG 纳米颗粒在黑暗中孵育 HUVECs 后的钙黄绿素 AM / 碘化丙啶(PI)染色的荧光成像。(d):用 50μg/mL 的 PTDG 纳米颗粒在黑暗中或 750nm 激光照射(0.7W/cm²)下孵育 4T1 细胞后的钙黄绿素 AM/PI 染色的荧光成像。
· 肿瘤血管破坏动态监测
4T1 荷瘤小鼠注射 PTG 或 PTDG 纳米颗粒后,肿瘤血管可清晰成像,PTDG 纳米颗粒注射后可实时监测肿瘤血管形态变化,10 分钟左右血管开始受损,35 分钟后严重破坏,而 PTG 纳米颗粒处理组无明显变化;激光散斑对比成像(LSCI)和免疫组化染色证实 PTDG 纳米颗粒可造成肿瘤血管严重损伤,归因于酸性肿瘤微环境下 DMXAA 的有效释放。
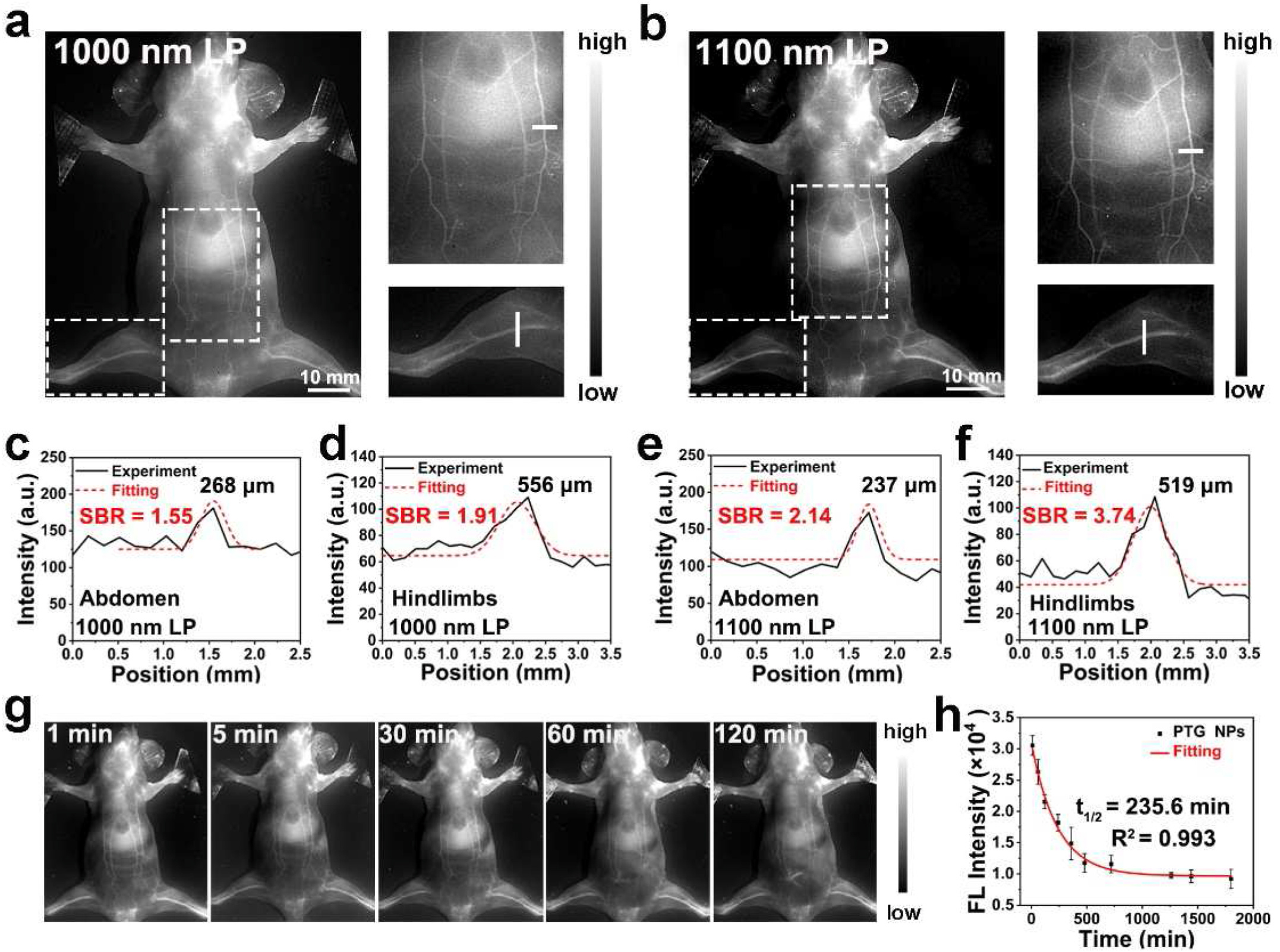
图 4(a)、(b)**:用 1000nm 和 1100nm 长通滤光片对尾静脉注射 PTG 纳米颗粒(150μL,2mg/mL)的 Balb/c 小鼠进行 NIR - II 全身血管成像以及放大的腹部和后肢血管(白色虚线框)图像。(c)、(d)**:使用 1000nm 长通滤光片时腹部和后肢血管沿白线的横截面 NIR - II 荧光强度分布。(e)、(f)**:使用 1100nm 长通滤光片时腹部和后肢血管沿白线的横截面 NIR - II 荧光强度分布。(g):注射 PTG 纳米颗粒后不同时间用 1100nm 长通滤光片对 Balb/c 裸鼠进行 NIR - II 荧光成像。(h):注射 PTG 纳米颗粒后不同时间血液样本的荧光强度随时间的变化。
· 长期肿瘤进展跟踪和体内联合治疗
PTDG 纳米颗粒在荷瘤小鼠体内主要分布于肝脏和脾脏,肿瘤部位也有较高积累,注射后 17 天仍可检测到荧光信号,可长期跟踪肿瘤进展,这得益于其在肿瘤微环境中酯键响应导致的聚集。体内联合抗血管 / 光热治疗实验表明,PTDG 纳米颗粒联合治疗组肿瘤生长得到完全抑制,组织学分析证实其抗肿瘤效果,且治疗过程中所有小鼠体重无异常变化,副作用可忽略不计。
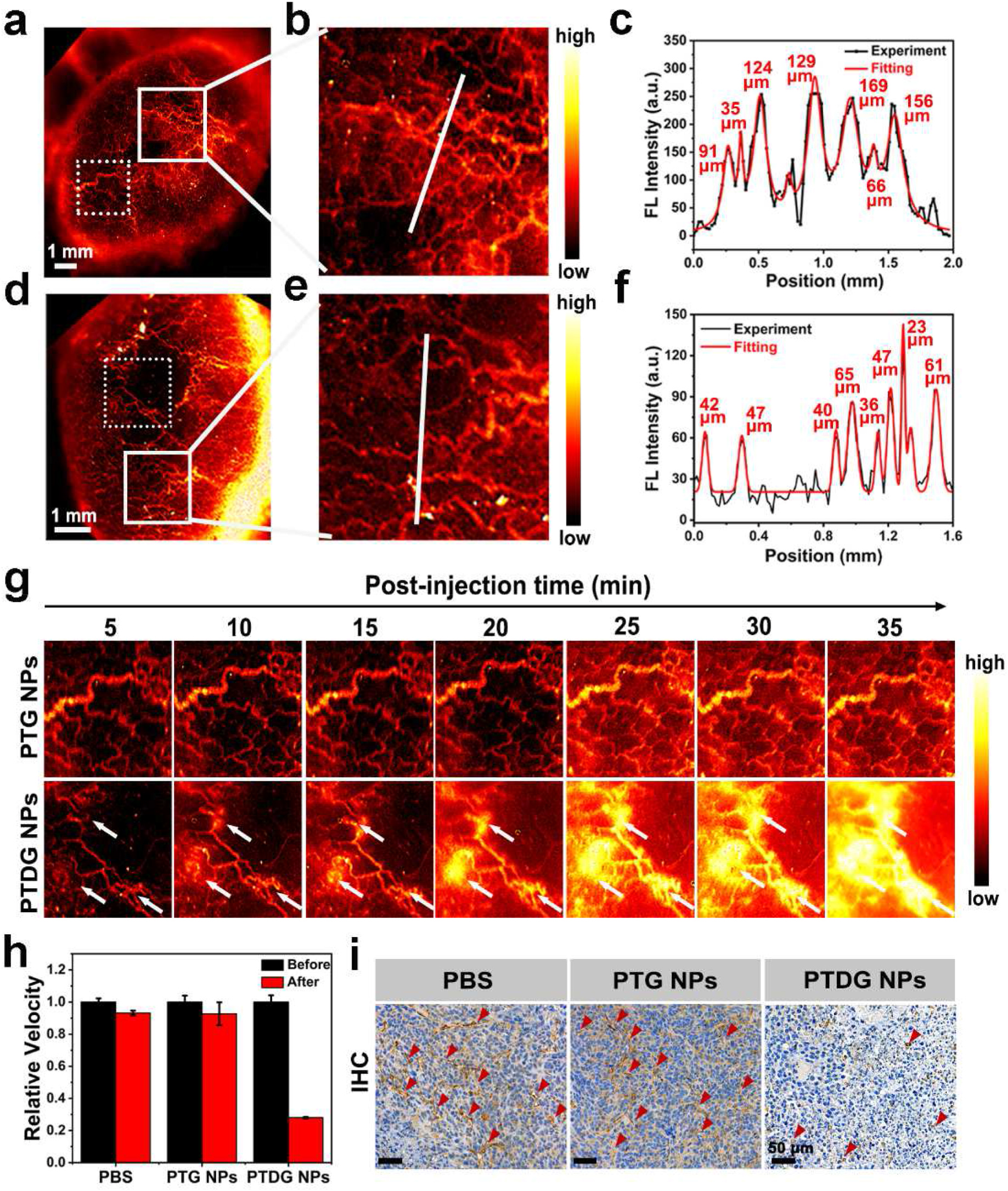
图 5(a):静脉注射 PTG 纳米颗粒后整个肿瘤血管的原位 NIR - II 荧光成像。(b):图 (a) 中白色实线框内放大的血管图像。(c):沿图 (b) 中白线的横截面 NIR - II 荧光强度分布以及使用 1100nm 长通滤光片的高斯拟合半高全宽(FWHM)。(d):静脉注射 PTDG 纳米颗粒后整个肿瘤血管的原位 NIR - II 荧光成像。(e):图 (d) 中白色实线框内放大的血管图像。(f):沿图 (e) 中白线的横截面 NIR - II 荧光强度分布以及使用 1100nm 长通滤光片的高斯拟合 FWHM。(g):分别注射 PTG 纳米颗粒和 PTDG 纳米颗粒后,通过对图 (a)、(d) 中白色虚线框内区域进行 NIR - II 荧光成像实时监测肿瘤血管形态演变。(h):通过激光散斑对比成像(LSCI)记录注射 PBS、PTG 纳米颗粒和 PTDG 纳米颗粒前后肿瘤血管的相对血流速度变化。(i):注射 PBS、PTG 纳米颗粒和 PTDG 纳米颗粒后用 CD31 对肿瘤血管进行免疫组化染色。比例尺:50μm。
研究结论
成功构建了基于 PT - 3 的 pH 响应性 NIR-II 纳米平台 PTDG 纳米颗粒,兼具高荧光亮度和良好光热效应,可实现肿瘤血管破坏过程实时监测、长期肿瘤进展跟踪和联合抗血管 / 光热治疗,为多功能响应性纳米平台构建和 NIR-II 荧光剂在体内生理过程动态监测中的应用提供了新方法。
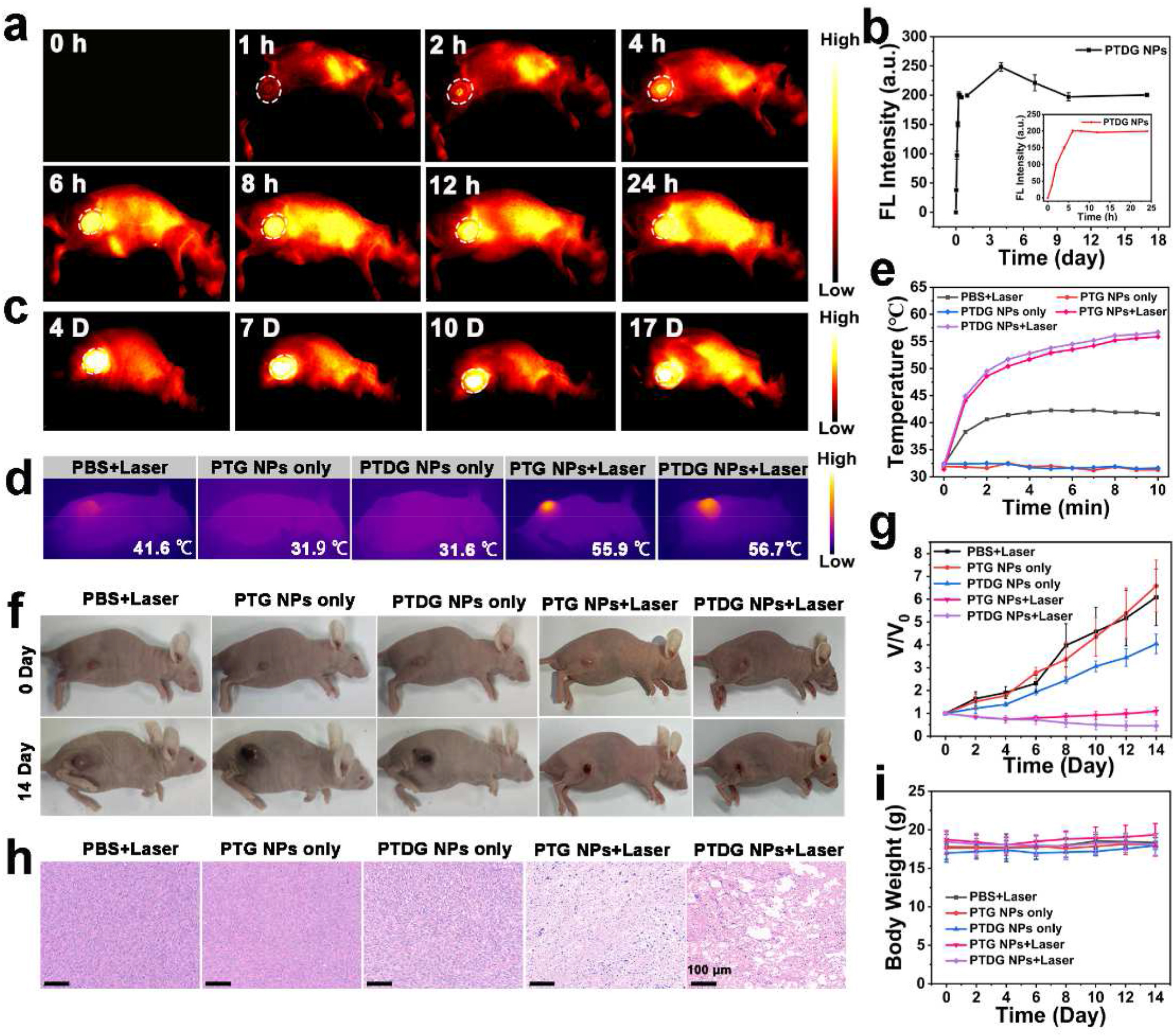
图 6(a):静脉注射 PTDG 纳米颗粒(150μL,2mg/mL)后 4T1 荷瘤小鼠在 24 小时内的 NIR - II 荧光成像。(b):静脉注射 PTDG 纳米颗粒后不同时间点肿瘤的平均荧光强度。(c):静脉注射 PTDG 纳米颗粒后 4T1 荷瘤小鼠在 17 天内的长期 NIR - II 荧光成像。(d):不同治疗组小鼠的红外热图像和 (e) 肿瘤温度变化。(f):不同治疗后 0 天和 14 天小鼠的照片。(g):不同治疗后随时间变化的肿瘤生长曲线(n = 5)。(h):不同治疗后肿瘤切片的苏木精 - 伊红(H&E)染色图像。(i):不同治疗后 4T1 荷瘤小鼠在接下来 14 天内的体重变化(n = 5)。