研究背景
在过去十年间,发光纳米晶体作为多功能诊疗纳米前药(NPDs),在早期癌症诊断和治疗方面发展迅速。镧系掺杂的发光纳米晶体因具有独特的上转换(UC)/ 近红外二区(NIR-II)荧光特性,以及可作为治疗成分的放射性镧系掺杂剂,在实际临床应用中展现出巨大潜力。当这些纳米前药表面功能化有肿瘤靶向配体时,能靶向肿瘤细胞的不同部位,提升治疗效果。然而,开发能够直接将诊断和治疗有效载荷输送到肿瘤细胞核的肿瘤细胞核靶向镧系诊疗纳米前药,仍然是一项极具挑战性的任务。
研究内容
(一)纳米前药的设计与制备
研究团队提出了一种新颖的设计策略,制备了用放射性镥 - 177(177Lu)标记的肿瘤细胞核靶向镧系诊疗纳米前药(177Lu-YNP@FA NPDs)。他们将镧系发光对 Yb/Er 和镧系放射性核素177Lu分别掺入NaYF4@NaYF4核壳纳米晶体的核层和壳层,使纳米前药能发出明亮的可见 UC 和 NIR - II 荧光,以及自发发射高能 β 射线辐射。同时,纳米晶体表面用 DSPE - PEG - FA 进行功能化修饰,DSPE - PEG - FA 作为肿瘤细胞核靶向配体,能特异性识别过表达叶酸受体 α(FR - α)的肿瘤细胞,如宫颈癌细胞系 Hela 细胞。
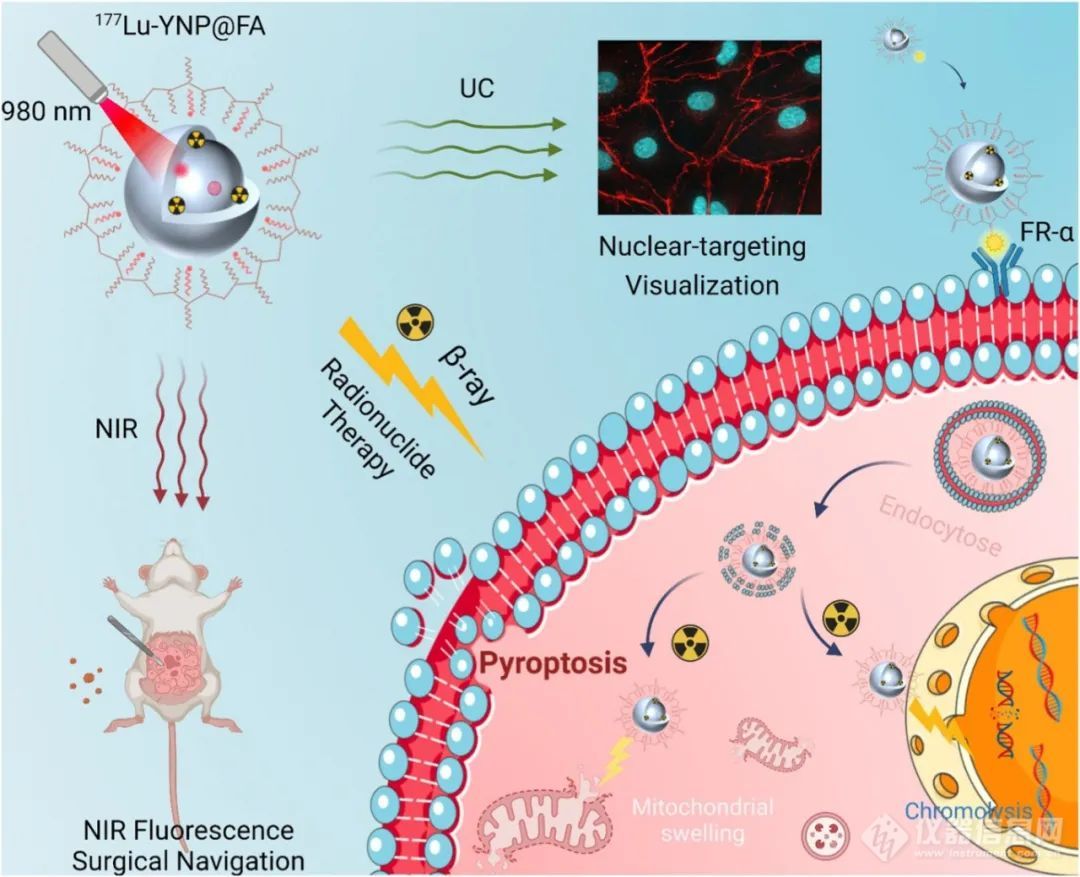
方案1:肿瘤细胞核靶向设计策略示意图177Lu-YNP@FA同时上转换/NIR-II扩散发光的NPD以及放射性β射线辐射在高效肿瘤扩散定位和放射性核素治疗中的作用。
通过两步外延生长法,再经疏水范德华相互作用进行表面功能化,成功构建了177Lu-YNP@FA纳米前药。透射电镜(TEM)和高分辨率透射电镜(HRTEM)图像显示,该纳米前药呈均匀球形,单分散性良好且为单晶结构。动态光散射(DLS)分析表明,其在生理盐水(NS)和胎牛血清(FBS)中的平均流体动力学尺寸分别约为 79nm 和 24nm,且在溶液中具有良好的长期稳定性。
(二)纳米前药的性能研究
1. 荧光性能:177Lu- YNP@FA 纳米前药在 980nm 二极管激光激发下,能在可见(~532 和~650nm)和 NIR - II(~1532nm)光谱区域同时发出明亮的 UC 和 NIR - II 荧光,且其光致发光(PL)稳定性明显优于美FDA批准的吲哚菁绿(ICG)染料。
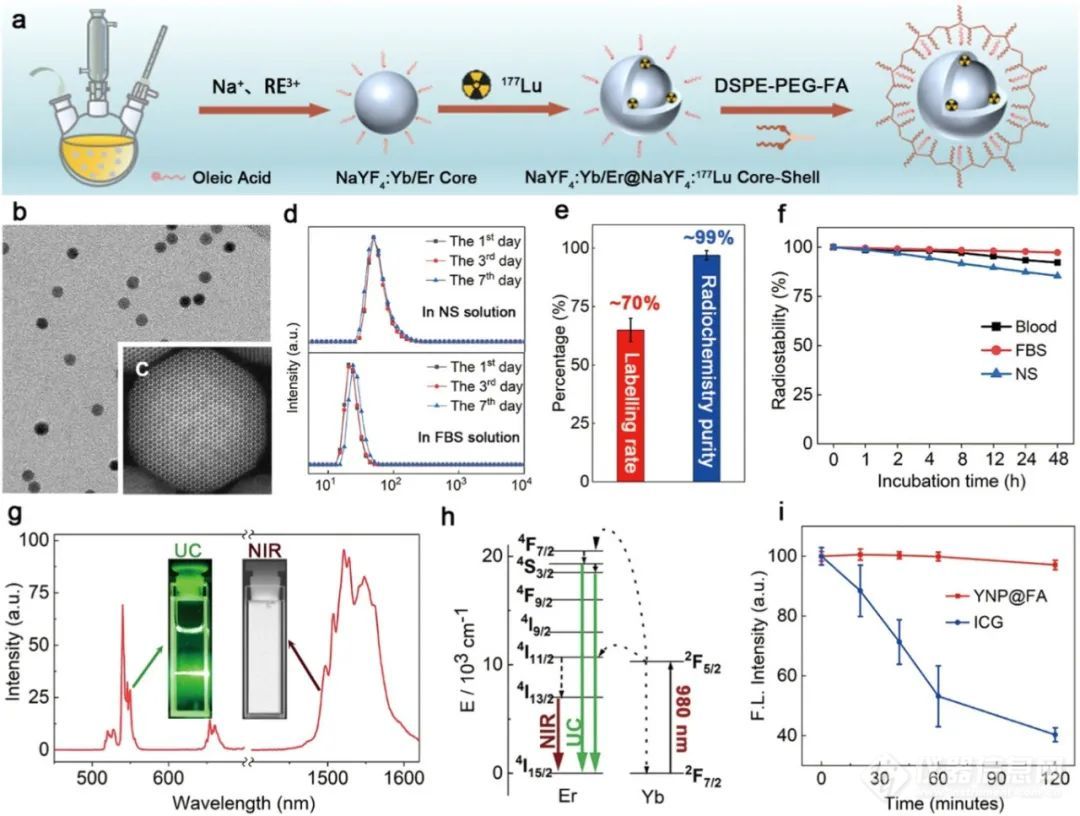
图1(a)肿瘤细胞核靶向制备过程示意图177Lu-YNP@FANPD。(b、c)代表性TEM和高分辨率TEM图像177Lu-YNP@FA水中的NPD。(d)随时间变化的平均水动力尺寸177Lu-YNP@FANS和FBS溶液中的NPD,显示其流体动力学尺寸随时间几乎不变,表明其具有长期的水稳定性。(e)177Lu放射性核素的放射性标记率和放射化学速率177Lu-YNP@FANPD。(f)放射性化学稳定性177Lu-YNP@FANPDs在NS、FBS和全血溶液中分散不同时间后。(g) Er3+的典型UC(左)和NIR-II荧光(右)光谱及其相应的PL图 177Lu-YNP@FA(h)简单的能级图,描绘了Yb3+和Er3+离子之间的能量转移过程,该过程负责在980nm二极管激光激发下产生明亮的UC和Er3+的NIR-II荧光。(i) 光稳定性比较177Lu-YNP@FANPD和FDA批准的ICG染料分别在连续980 nm二极管激光照射(~100 mW cm-2)和650 nm氙灯(~5 mW cm-2)下照射120min
2. 靶向能力:利用定制的共聚焦激光扫描显微镜(CLSM)系统,以Er3+的可见 UC 荧光为荧光指示剂,研究发现 Hela 细胞与177Lu- YNP@FA 纳米前药孵育 8h后,细胞核内呈现强烈的绿色 UC 荧光,而正常人类永生化角质形成细胞(HaCaT)几乎检测不到 UC 荧光信号。在共培养实验中,纳米前药也主要定位于 Hela 细胞的细胞核。这表明177Lu- YNP@FA 纳米前药对宫颈癌细胞核具有特异性靶向能力。此外,该纳米前药能在 4h内进入 Hela 细胞并到达细胞核,通过配体(DSPE - PEG - FA)与受体(FR - α)的相互作用,在 8h内快速靶向 Hela 细胞核。
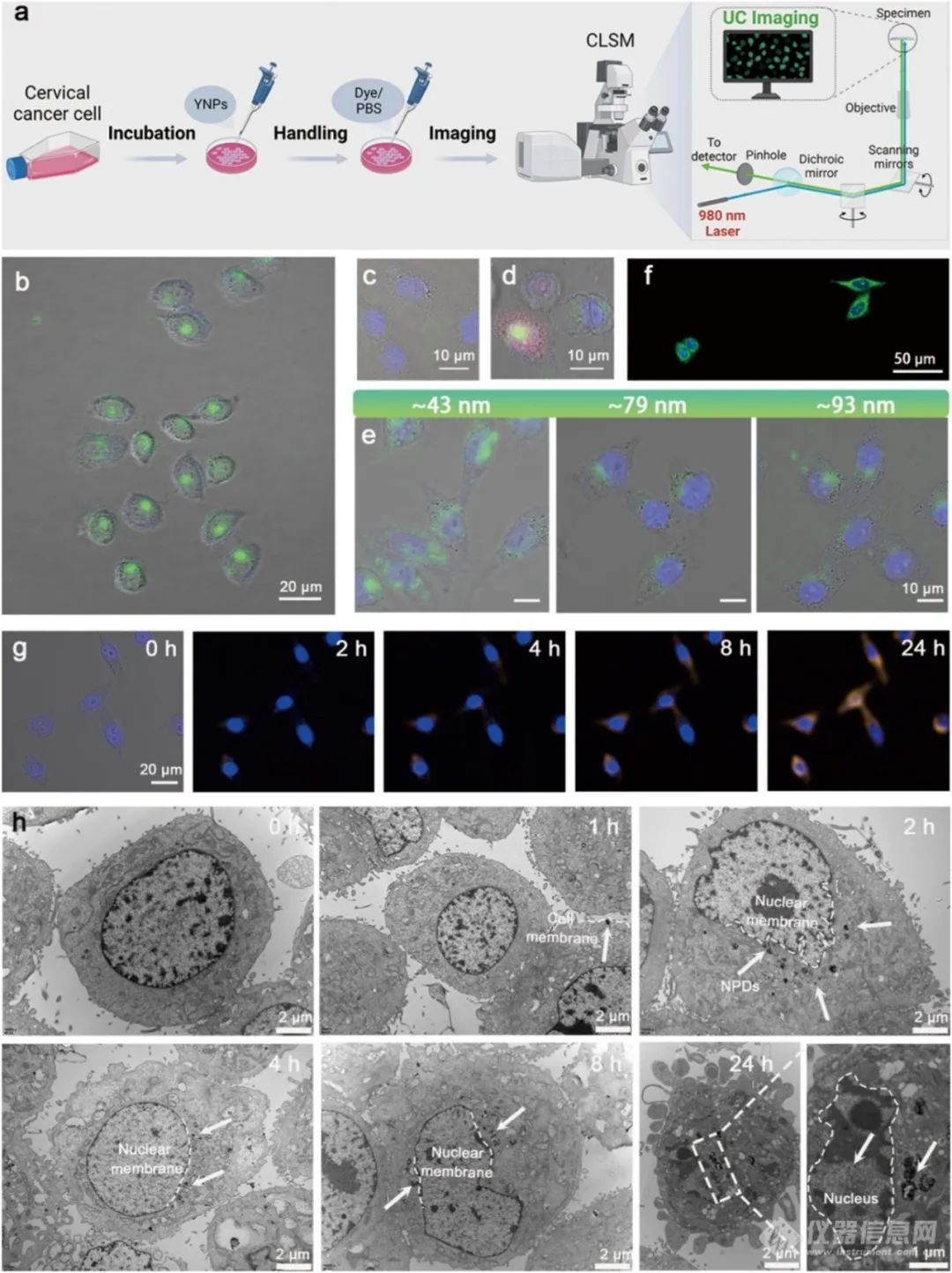
图2(a)配备980nm激发光源的定制CLSM系统中肿瘤细胞靶向UC成像的示意图。(b)Hela、(c)HaCaT和(d)与Hela-mCherry和HaCaT细胞共培养后的代表性UC CLSM图像177Lu-YNP@FA(80µg/mL,10µL)NPD处理8h(λexc=980 nm,λem=532 nm)。(e) Hela细胞在孵育后的UC CLSM图像比较177Lu-YNP@FANPDs具有不同的流体动力学尺寸,跨度为~43-93nm,持续4h。(f)用Alexa Fluor®488染色的Hela细胞的免疫荧光图像(λexc=495nm,λem=519nm),表明FR-α在Hela细胞细胞质和细胞核中都过表达。(g) 与Hela细胞一起孵育的原位时间依赖性UC CLSM图像177Lu-YNP@FA浓度为80µg/mL的NPDs。(h)用以下物质孵育的Hela细胞的代表性生物TEM图像177Lu-YNP@FA在指定时间点的NPDs(80µg/mL,10µL),其中细胞对177Lu-YNP@FANPD用白色箭头标记。
3. 体内肿瘤靶向与治疗效果:在体内实验中,利用 BALB/c 裸鼠腹腔转移性宫颈癌模型,通过 NIR - II 荧光成像发现,177Lu- YNP@FA纳米前药能精准定位小鼠腹腔内的转移性宫颈癌肿瘤,且离散的荧光信号与 ICG 处理的对照组明显不同。经 NIR - II 荧光成像引导手术切除的组织,经苏木精 - 伊红(H&E)染色证实为转移性宫颈癌肿瘤,这证明了该纳米前药在活体小动物中具有出色的特异性肿瘤靶向能力。
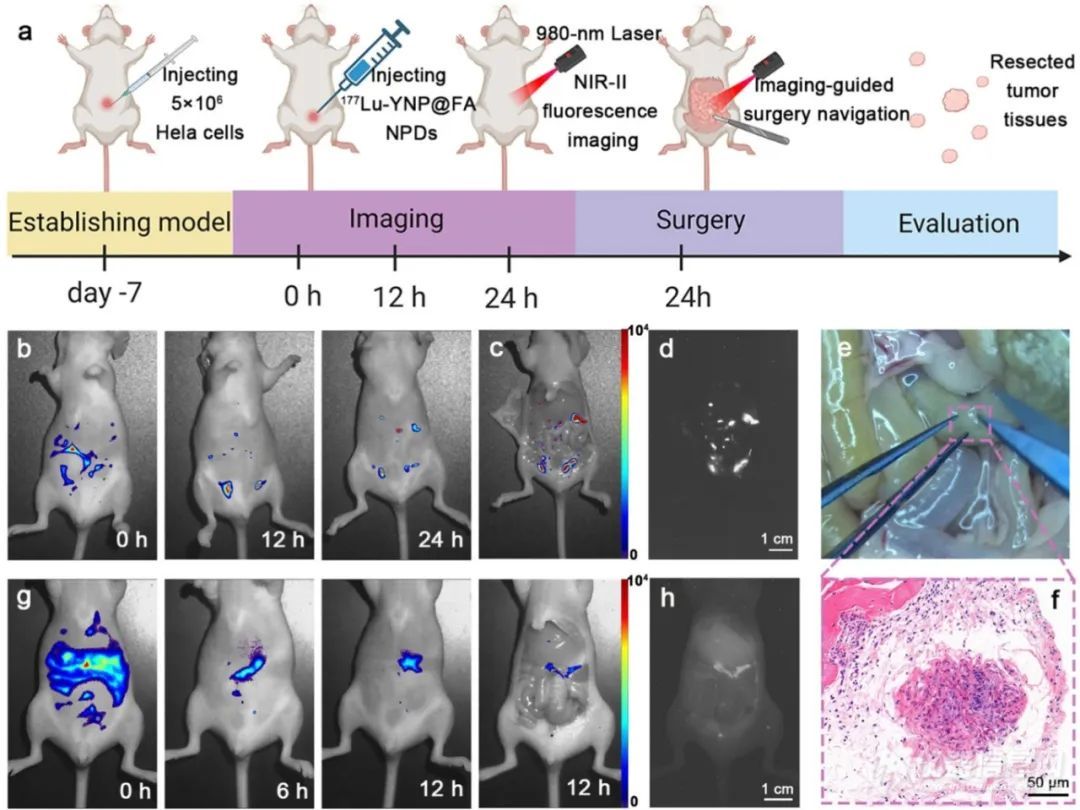
图3(a) BALB/c裸鼠腹腔转移性宫颈癌的体内肿瘤定位和手术切除示意图177Lu-YNP@FA基于NIR-II荧光成像的NPD。(b) 体内分布177Lu-YNP@FA腹腔注射0-24h后,使用我们自制的NIR-II荧光显微镜成像系统观察携带转移性宫颈癌的BALB/c裸鼠腹腔中的NPD。(g-h)ICG处理的对照BALB/c裸小鼠的体内近红外荧光成像,显示临床使用的ICG染料缺乏肿瘤靶向能力。(b、c、d、g、h都由睿光科技的NirVivo-Pro小动物活体成像系统拍摄)
在抗癌效果方面,体外实验表明,与游离的177LuCl3和 YNP@FA 对照组相比,177Lu- YNP@FA 纳米前药对 Hela 细胞具有显著更高的抑制能力,且呈辐射剂量依赖性。在超低辐射剂量下,就能杀死大量 Hela 细胞。进一步研究发现,其增强的抗癌效果主要归因于细胞焦亡,而非细胞凋亡。
体内实验以 BALB/c 裸鼠皮下宫颈癌肿瘤模型进行,177Lu- YNP@FA 纳米前药在肿瘤中的生物半衰期约为 7.1 天,具有优异的肿瘤积累和保留能力,能有效抑制宫颈癌肿瘤生长,且在治疗过程中对小鼠体重影响较小,无明显副作用。治疗后对肿瘤组织的组织病理学分析也证实了其良好的抗肿瘤效果。
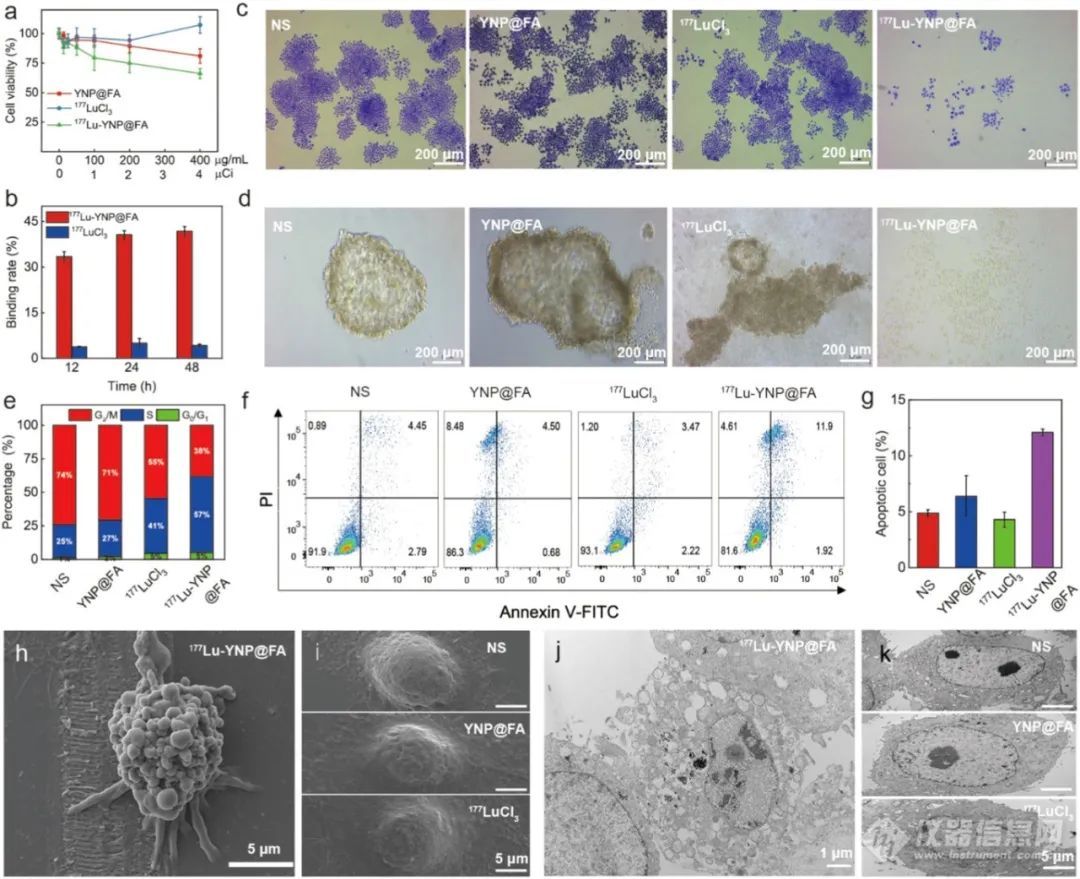
图4(a) 用游离177LuCl3孵育后Hela细胞的细胞活力,YNP@FA以及177Lu-YNP@FA当在水中分散48h时,不同剂量的NPDs。(b)游离177LuCl3和177Lu-YNP@FA通过放射测量法测定Hela细胞的NPDs。(c)细胞集落形成,(d)球体形成能力,以及Hela细胞在用生理盐水(NS)、游离177LuCl3(~6µCi)处理后的(e)细胞周期分布和(f,g)细胞凋亡的流式细胞术研究,YNP@FA,以及177Lu-YNP@FA用NS、游离177LuCl3(~6µCi)处理后,一些随机选择的Hela细胞的代表性(h,i)SEM和(j,k)生物TEM图像,YNP@FA,以及177Lu-YNP@FA(~6µCi)NPD持续24h。
4. 生物相容性:对接受不同处理的皮下宫颈癌荷瘤 BALB/c 裸鼠进行血液学和组织学检测,结果显示,177Lu- YNP@FA 纳米前药治疗后,小鼠血液中与肿瘤相关的炎症细胞水平显著降低,血液中乳酸脱氢酶(LDH)含量也明显低于对照组,且其他生化指标无显著变化。主要器官的 H&E 染色图像显示,该纳米前药对正常组织无明显病理炎症或损伤,表明其具有良好的生物相容性和生物an全性。
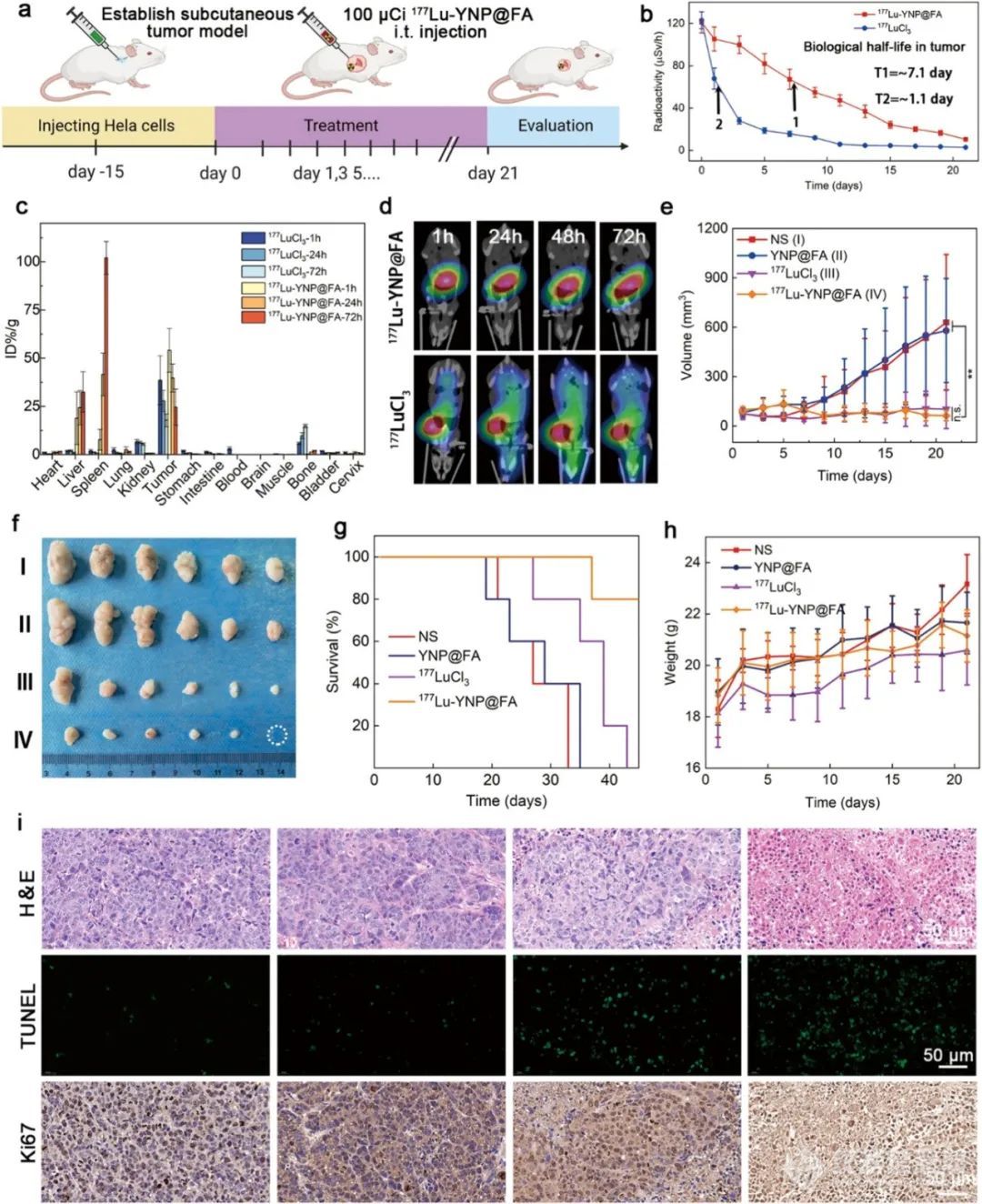
图5(a) 皮下宫颈癌单次瘤内注射治疗方案示意图。(b) 携带皮下宫颈癌的BALB/c裸鼠在瘤内注射游离177LuCl3和177Lu-YNP@FANPDs的剂量约为100µCi。(c) 游离177LuCl3和177Lu-YNP@FA用γ计数器测量不同时间携带BALB/c裸鼠皮下宫颈癌的NPDs。(d) 携带皮下宫颈癌的BALB/c裸小鼠在接受单次瘤内注射游离177LuCl3和177Lu-YNP@FANPDs的剂量约为100µCi。(e) 游离177LuCl3(~100µCi)生理盐水的肿瘤生长曲线,YNP@FA,以及177Lu-YNP@FA(~100µCi)治疗携带宫颈癌的BALB/c裸鼠(n=6)。通过Student t检验计算统计显著性。无统计学意义:p>0.05,**p<0.01。(f) (e)中治疗后21天每组解剖肿瘤组织的数码照片。(g) 不同处理42天后,携带皮下宫颈癌的BALB/c裸鼠的存活率和(h)体重情况(n=6)。(i) 分别用H&E、TUNEL和Ki-67抗原对每组解剖的肿瘤组织进行病理分析。
研究意义
这项研究开发出了肿瘤细胞核靶向的镧系诊疗纳米前药,为精确的肿瘤荧光定位和有效的放射性核素治疗提供了新方法。177Lu- YNP@FA 纳米前药能快速靶向 Hela 细胞核,实现对微小转移性宫颈癌肿瘤的精准定位和切除,且在体内外均展现出优异的抗肿瘤效果。其抗肿瘤效果主要源于细胞焦亡,而非细胞凋亡。这些研究结果为开发多种基于镧系的诊疗纳米前药奠定了基础,有望在未来实现an全有效的癌症放射治疗。